LAPORAN PRAKTIKUM KIMIA DASAR A1 PEMBUATAN LARUTAN
LAPORAN PRAKTIKUM KIMIA DASAR A1
PEMBUATAN LARUTAN

PROGRAM STUDI KIMIA
FAKULTAS SAINS DAN TEKNOLOGI
UIN SYARIF HIDAYATULLAH JAKARTA
2022
BAB I
PENDAHULUAN
1.1. Prinsip Percobaan
Prinsip percobaan pada pembuatan larutan ini dilakukan dengan menghitung massa suatu padatan senyawa pekat untuk membuat larutan dengan ditambahkan aquades sebagai pelarut. Selanjutnya prinsip kerja pengenceran dengan menghitung volume senyawa pekat sebagai terlarut dan menggunakan aquades sebagai pelarut. Hasilnya akan menjadi suatu larutan homogen dengan konsentrasi akhir yang diinginkan.
1.2. Tujuan Percobaan
1. Mahasiswa mampu membuat larutan dari zat berfasa padatan dan zat berfasa cairan pekat .
2. Mahasiswa mampu menentukan massa dan volume zat yang digunakan pada proses pembuatan larutan serta menghitung konsentrasi larutan yang dibuat dengan berbagai jenis satuan konsentrasi (molaritas, molalitas, persen, ppm, fraksi mol dan normalitas).
BAB II
TINJAUAN PUSTAKA
3 macam konsentrasi dalam persen yaitu: persen bobot/bobot (% w/w) menyatakan banyaknya gram zat terlarut dalam 100 gram larutan, persen volume/volume (% v/v) menyatakan banyaknya mL zat terlarut dalam 100 mL larutan, persen bobot/volume (% w/v) menyatakan banyaknya gram zat terlarut dalam 100 mL larutan.
b. Konsentrasi dalam fraksi mol
Fraksi mol (x) menyatakan mol zat terlarut per mol total.
c. Konsentrasi dalam part per million (ppm)
Sistem part per million (ppm) ini memberikan berapa bagian satu komponen itu dalam 1 juta bagian campuran. ppm atau bagian per sejuta menyatakan mg zat terlarut dalam 1 kg atau 1 liter larutan.
d. Konsentrasi dalam Molaritas (M)
Molaritas (M) menyatakan banyaknya mol zat terlarut per liter larutan. Karena konsentrasi dalam molar merupakan konsentrasi berdasarkan volume, sedangkan volume merupakan fungsi dari suhu maka molaritas dipengaruhi oleh suhu.
e. Konsentrasi dalam molalitas (m)
Molalitas (m) adalah banyaknya mol zat terlarut dalam 1000 gram pelarut. Karena bobot tidak dipengaruhi oleh suhu maka molalitas adalah konsentrasi yang bebas dari pengaruh suhu.
f. Konsentrasi dalam Normalitas (N)
Seperti molalitas, sistem konsentrasi ini didasarkan pada volume larutan. Normalitas (N) menyatakan banyaknya ekuivalen zat terlarut per liter larutan. Ekuivalen ini merupakan banyaknya suatu zat yang memberikan atau bereaksi dengan 1 mol H+ (asam dan basa), 1 mol elektron (redoks), atau 1 mol kation bervalensi satu (pengendapan dan pembentukan kompleks).
Dalam membuat larutan standar baik larutan NaOH dari NaOH padat harus dilakukan perhitungan massa NaOH padat yang dibutuhkan untuk membuat larutan NaOH pada konsentrasi tertentu. Sedangkan, pada pembuatan larutan HCl dari pengenceran HCl pekat terlebih dahulu harus ditentukan nilai konsentrasi HCl pekat yang akan digunakan. Oleh karena itu, tentukan dahulu berapa banyak larutan standar yang akan dibuat dan hitung berapa banyak larutan asli yang harus diencerkan. Jika dilakukan pembuatan larutan dengan konsentrasi lebih kecil dari konsentrasi awal pengenceran, digunakan persamaan pengenceran yaitu:
V1 × N1 = V2 × N2
Dimana :
V1 = Volume larutan asli yang dipakai atau diperlukan
N1 = Konsentrasi larutan asli atau awal
V2 = Volume larutan standar yang akan dibuat
N2 = Konsentrasi larutan standar yang akan dibuat
BAB III
METODE PERCOBAAN
3.1. Alat
2 buah labu ukur 100 mL, 1 buah labu ukur 50 mL, 1 buah pipet ukur 5 mL, 1 buah pipet ukur 1 mL, 1 buah gelas ukur 50 mL, 2 buah pipet tetes, 1 buah gelas piala 100 mL, 1 buah corong, 1 buah termometer, 1 buah botol semprot, 1 buah batang pengaduk, dan 1 buah spatula.
3.2. Bahan
H2SO4 pekat, HCl pekat, NaOH padat, dan Aquades.
3.3. Pembuatan larutan HCl 0,1 N
Konversi 37% ke N
3.4. Pembuatan larutan Baku Primer NaOH 0,1 N
3.5. Pembuatan larutan H2SO4
BAB IV
HASIL DAN PEMBAHASAN
4.1. Hasil Pengamatan
4.2. Hasil Perhitungan
1. Perhitungan pembuatan Larutan HCl 0,1 N
Diketahui :
N2 = 0,1 N
V2 = 100 mL
Bahan HCl pekat 37%
BJ = 1,19 kg/L
BE = 36,5
Ditanya : V1?
Dijawab :
V HCl pekat yang diperlukan untuk membuat larutan HCl 0,1 N sebanyak 100 mL adalah 0,83 mL.
2. Perhitungan pembuatan Larutan Baku Primer NaOH 0,1 N
Diketahui :
N = 0,1 N
BE = 40
V = 100 mL
Ditanya : massa?
Dijawab :
Massa NaOH yang ditimbang adalah 0,4 gram.
3. Perhitungan pembuatan Larutan H2SO4
Diketahui :
Volume larutan = 50 mL
Volume H2SO4 = 3 mL
Mr H2SO4 = 98
BE = 49
Ditanya : %(W/W), %(V/V), %(W/V), fraksi mol, ppm, Molaritas, Molalitas, dan Normalitas?
Dijawab :
4.3. Pembahasan
Pada praktikum kali ini, dilakukan beberapa percobaan untuk menentukan konsentrasi suatu larutan. pada percobaan pertama pembuatan larutan HCl 0,1 N dilakukan dengan memasukkan aquades ke dalam labu ukur 100 mL, hal ini bertujuan aquades berfungsi sebagai penetral panas yang dihasilkan HCl pekat ini. Apabila larutan HCl pekat ini terlebih dahulu mengisi labu ukur maka panas yang dihasilkan dapat membuat percikan. Dan hal ini dijelaskan dalam proses eksoterm, yaitu proses eksoterm melepaskan panas ke lingkungannya menyebabkan suhunya naik seiring dengan berlangsungnya reaksi (Nurul, Silmi. 2020). Setelah memasukkan ke dalam labu ukur maka ditambahkannya kembali aquades hingga tanda batas dan dikocok hingga homogen. Pada pembuatan larutan ini telah dihitung bahwa V HCl pekat yang diperlukan untuk membuat larutan HCl 0,1 N adalah 0,83 mL. Asam klorida bersifat korosif yang berarti akan merusak dan mengikis jaringan biologis bila tersentuh, oleh karena itu disarankan bahwa seseorang yang menangani HCl harus menggunakan sarung tangan, kacamata, dan masker.
Pada percobaan yang kedua dilakukan pembuatan larutan baku primer Natrium Hidroksida (NaOH) 0,1 N. Pada pembuatan larutan NaOH 0,1 N dilakukan dengan metode penimbangan dan pelarutan. Mula-mula padatan NaOH ditimbang, lalu dimasukan ke dalam gelas piala dan dilarutkan dengan aquades sambil diaduk. Setelah itu dimasukkan ke dalam labu ukur 100 mL, dengan ditambahkan aquades hingga tanda batas dan dikocok hingga homogen. Pada pembuatan larutan ini telah dihitung bahwa massa NaOH yang ditimbang adalah 0,4 gram. Karakteristik padatan NaOH berwarna putih atau praktis putih, berbentuk butiran kecil, bila dibiarkan di udara akan cepat menyerap karbondioksida dan lembab, mudah larut dalam air dan dalam etanol tetapi tidak larut dalam eter.
Pada percobaan yang ketiga dilakukan pembuatan larutan H2SO4 yang belum diketahui konsentrasinya. Sehingga diperlukan mencari konsentrasi dalam bentuk %(w/w),%(w/v), %(v/v), fraksi mol, ppm, molaritas, molalitas, dan normalitas. Pada percobaan ini diperlukan beberapa data untuk menentukan konsentrasi yang diinginkan. Mula-mula dilakukannya penimbangan labu ukur 50 mL kosong sebagai "a" yaitu 34,37 gram, lalu ditambahkan 30 mL aquades ke dalam labu ukur tersebut, dan mengukur suhunya sebagai T1 yaitu 28° C. Setelah itu, menimbang labu ukur yang berisi aquades sebagai "b" yaitu 63,43 gram, lalu ditambahkannya 3 mL H2SO4, mengukur suhu kembali sebagai T2 yaitu 47°C. Kemudian, menimbang kembali labu ukur yang telah ditambahkan H2SO4 sebagai "c" yaitu 68,96 gram, masukkan kembali aquades hingga tanda batas, dikocok hingga homogen. Terakhir, timbang kembali sebagai "d" yaitu 86,43 gram.
Pada saat penambahan H2SO4 kedalam labu ukur berisi aquades terjadi perubahan suhu pada 28°C menjadi 47°C. Hal ini disebabkan karena proses eksoterm sehingga temperatur larutan menjadi meningkat. Pada pembuatan larutan ini telah diketahui bahwa konsentrasi dalam persen yang pertama persen bobot/bobot %(w/w) adalah 6,2%, yang kedua persen volume/volume %(v/v) adalah 6%, dan yang ketiga persen bobot/volume %(w/v) adalah 10,86%. Kemudian fraksi mol nya adalah 0,02. ppm nya adalah 108.600 ppm, molaritas nya adalah 1,1 M, molalitas nya 1,18 m, dan normalitas nya adalah 2,2 N. H2SO4 atau asam sulfat merupakan asam mineral (anorganik) yang kuat. Zat ini larut dalam air pada semua perbandingan. Karakteristik H2SO4 yaitu tidak berwarna, memiliki bau yang tidak menyengat, serta memiliki suhu ruang (tidak panas).
BAB V
KESIMPULAN
1. Membuat larutan dari zat berfasa cairan pekat dapat dilakukan dengan mencampurkan HCl pekat sebagai zat terlarut dengat Aquades sebagai zat pelarut. Lalu dapat dilakukan dengan mencampurkan H2SO4 sebagai zat terlarut dengan Aquades sebagai zat pelarut. Untuk membuat larutan berfasa zat padat dapat dilakukan dengan cara menimbang padatan NaOH terlebih dahulu sesuai perhitungan, kemudian dicampurkan dengan Aquades sebagai zat pelarut dan diaduk.
2. Menentukan massa dan volume zat dapat dilakukan dengan menimbang dari setiap tahap ; labu ukur kosong (a), labu ukur ditambah Aquades (b), labu ukur ditambah aquades dan cairan pekat (c), dan berat keseluruhan larutan (d). Sehingga dari data tersebut kita dapat menghitung konsentrasi larutan yang dibuat dengan berbagai jenis satuan konsentrasi (% w/w, % v/v, % w/v, fraksi mol, ppm, molaritas, molalitas, dan normalitas).
DAFTAR PUSTAKA
Khikmah, N. 2015. Pengaruh Konsentrasi NaOH dan Laju Alir pada Penentuan Kreatinin Dalam Urin Secara Sequential Injection Analysis. Kimia Student Journal. Vol.1 (1) : 613-615.
Kompas.com. (2020, 7 Oktober). Perbedaan Reaksi Endoterm dan Eksoterm. Diakses pada 15 Oktober 2022, dari https://www.kompas.com/skola/read/2020/10/07/122600069/perbedaan-reaksi-endoterm-dan-eksoterm#page2
Nurhasni, Yusraini DIS. 2022. Modul Praktikum Kimia Dasar 1. Jakarta : UIN Syarif Hidayatullah Jakarta.
Petrucci, R.H. 1985. Kimia Dasar Prinsip dan Terapan Modern Jilid 2. Jakarta : Gramedia
Styarini, L. W. 2012. Perancangan Sistem Pengukuran Konsentrasi Larutan Gula Menggunakan Metode Difraksi. Jurnal Teknik Pomits. Vol.1 (1) : 1-5.
EVALUASI POST PRAKTIKUM
1. Pembuatan larutan HCl 0,1 N
V HCl pekat yang diperlukan untuk membuat larutan HCl 0,1 N sebanyak 100 mL adalah 0,83 mL.
2. Pembuatan larutan baku primer NaOH
Massa NaOH yang ditimbang = 0,4 gram
3. Pembuatan larutan H2SO4
Berat labu ukur kosong a = 34,27 gram
Berat aquades + labu ukur b = 63,43 gram
Berat aquades + labu ukur + H2SO4 c = 68,86 gram
Berat campuran d = 86,43 gram
Tentukan konsentrasi H2SO4 yang dihasilkan dalam satuan konsentrasi (% w/w, % v/v, % w/v, fraksi mol, ppm, molaritas, molalitas, dan normalitas).
LAMPIRAN
MSDS (Material Safety Data Sheets)
1. Aquades (H2O)
Sifat Fisika dan Kimia
Keadaan Fisik : cair
Penampilan : tidak berwarna, bening, putih air
Bau : tidak berbau
pH : tidak tersedia
Tekanan Uap : 17,5 mm Hg pada 20°C
Kepadatan Uap : tidak tersedia
Tingkat Penguapan : tidak tersedia
Titik Didih : 100°C
Titik Beku/Lebur : tidak tersedia
Suhu Dekomposisi : tidak tersedia
Kelarutan : tidak tersedia
Gravitasi/Kepadatan Spesifik : 1.000
Berat Molekul : 18.0134
Bahaya
Mata: Tidak mengiritasi mata.
Kulit: Tidak menyebabkan iritasi pada kulit.
Tertelan: Tidak ada bahaya yang diharapkan dalam penggunaan industri normal.
Terhirup: Diperkirakan tidak ada bahaya dalam penggunaan industri normal.
Kronis: Tidak ada.
Penanganan
Mata: Tidak diperlukan perawatan khusus, karena bahan ini tidak mungkin berbahaya.
Kulit: Tidak diperlukan perawatan khusus, karena bahan ini tidak berbahaya.
Tertelan: Tidak diperlukan perawatan khusus, karena bahan ini diharapkan tidak berbahaya.
Terhirup: Tidak diperlukan perawatan khusus karena bahan ini tidak mungkin berbahaya jika terhirup.
2. Asam klorida (HCl)
Sifat Fisika dan Kimia
Keadaan Fisik : cair
Penampilan : jernih, tidak berwarna hingga kuning pucat
Bau : kuat, menyengat
pH : 0,01
Tekanan Uap : 84 mm Hg pada 20°C
Densitas Uap : 1,27 (udara=1)
Laju Penguapan : > 1,00 (N-butil asetat)
Titik didih : 83°C pada 760 mmHg
Titik Beku/ Leleh : -66°C
Kelarutan : Larut.
Berat Jenis : 1,19 (38%)
Berat Molekul : 36,46
Bahaya
Mata: Dapat menyebabkan cedera mata ireversibel. Uap atau kabut dapat menyebabkan iritasi dan luka bakar yang parah. Kontak dengan cairan bersifat korosif pada mata dan menyebabkan luka bakar yang parah.
Kulit: Kontak dengan cairan bersifat korosif dan menyebabkan luka bakar dan ulserasi yang parah. Tingkat keparahan cedera tergantung pada konsentrasi larutan dan durasi paparan.
Tertelan : Menyebabkan luka bakar saluran pencernaan yang parah dengan sakit perut, muntah, dan kemungkinan kematian. Dapat menyebabkan korosi dan kerusakan jaringan permanen pada kerongkongan serta saluran pencernaan.
Terhirup: Dapat berakibat fatal jika terhirup. Dapat menyebabkan iritasi parah pada saluran pernapasan dengan sakit tenggorokan, batuk, sesak napas dan edema paru yang tertunda. Menyebabkan luka bakar kimia pada saluran pernapasan. Menyebabkan tindakan korosif pada selaput lendir.
Kronis: Kontak kulit yang berkepanjangan atau berulang dapat menyebabkan dermatitis. Paparan berulang dapat menyebabkan erosi gigi. Paparan berulang terhadap uap atau kabut HCl konsentrasi rendah dapat menyebabkan pendarahan pada hidung dan gusi. Bronkitis kronis dan gastritis juga telah dilaporkan.
Penanganan
Mata: Jika terjadi kontak, segera basuh mata dengan banyak air setidaknya selama 15 menit. Dapatkan bantuan medis segera.
Kulit: Jika terjadi kontak, segera basuh kulit dengan banyak air selama minimal 15 menit sambil melepaskan pakaian dan sepatu yang terkontaminasi. Dapatkan bantuan medis segera. Cuci pakaian sebelum digunakan kembali.
Tertelan: Jika tertelan, jangan dimuntahkan. Dapatkan bantuan medis segera. Jika korban sadar penuh, berikan segelas air. Jangan pernah memberikan apapun melalui mulut kepada orang yang tidak sadarkan diri.
Terhirup: bahan Racun. Jika terhirup, segera dapatkan bantuan medis.
3. Natrium hidroksida (NaOH)
Sifat Fisika dan Kimia
Keadaan Fisik : padat
Penampilan : putih
Bau : tidak berbau
PH : 14
Tekanan Uap : 1 mm Hg pada 739°C
Kepadatan Uap: tidak tersedia
Tingkat Penguapan: tidak tersedia
Viskositas: tidak tersedia
Titik Didih : 1390°C pada 760 mmHg
Titik Beku/Leleh : 318°C
Suhu Dekomposisi : tidak tersedia
Kelarutan : Larut
Gravitasi/Kepadatan Spesifik: 2,13 g/cm3
Berat Molekul : 40
Bahaya
Mata: Menyebabkan luka bakar pada mata. Dapat menyebabkan kebutaan. Dapat menyebabkan konjungtivitis kimia dan kerusakan kornea.
Kulit: Menyebabkan kulit terbakar. Dapat menyebabkan borok kulit yang dalam dan tembus.
Tertelan: Dapat menyebabkan kerusakan parah dan permanen pada saluran pencernaan. Menyebabkan luka bakar pada saluran pencernaan. Dapat menyebabkan perforasi saluran pencernaan. Menyebabkan sakit parah, mual, muntah, diare, dan syok.
Terhirup: Iritasi dapat menyebabkan pneumonitis kimia dan edema paru. Menyebabkan iritasi parah pada saluran pernapasan bagian atas dengan batuk, luka bakar, kesulitan bernapas, dan kemungkinan koma. Menyebabkan luka bakar kimia pada saluran pernapasan.
Kronis: Kontak kulit yang berkepanjangan atau berulang dapat menyebabkan dermatitis. Efek mungkin tertunda
Penanganan
Mata: Jika terjadi kontak, segera basuh mata dengan banyak air selama minimal 15 menit. Dapatkan bantuan medis segera.
Kulit: Jika terjadi kontak, segera basuh kulit dengan banyak air selama minimal 15 menit sambil melepaskan pakaian dan sepatu yang terkontaminasi. Dapatkan bantuan medis segera. Cuci pakaian sebelum digunakan kembali.
Tertelan : Jika tertelan, JANGAN dimuntahkan. Dapatkan bantuan medis segera. Jika korban sadar penuh, berikan segelas air. Jangan pernah memberikan apapun melalui mulut kepada orang yang tidak sadarkan diri.
Terhirup: Jika terhirup, pindahkan ke udara segar. Jika tidak bernapas, berikan pernapasan buatan. Jika sulit bernafas, berikan oksigen. Dapatkan bantuan medis.
4. Asam sulfat (H2SO4)
Sifat Fisika dan Kimia
Berat Molekul : 98,07
Keadaan Fisik : cair
Penampilan : berminyak,bening, tidak berwarna hingga kuning
Bau : tidak berbau
pH : 0,3 (larutan 1N)
Tekanan Uap : < 0,001 mm Hg pada 20°C
Kepadatan Uap : 3,38 (udara = 1)
Tingkat Penguapan : lebih lambat dari eter.
Viskositas : 21 mPas pada 25°C
Titik Didih : 290-338°C
Titik Beku/Leleh : 10°C
Suhu Dekomposisi : 340°C
Kelarutan : Larut dengan banyak panas
Bahaya
Mata: Menyebabkan luka bakar mata yang parah. Dapat menyebabkan cedera mata ireversibel. Dapat menyebabkan kebutaan.
Kulit: Menyebabkan kulit terbakar. Tingkat keparahan cedera tergantung pada konsentrasi larutan dan durasi paparan.
Tertelan: Dapat menyebabkan kerusakan parah dan permanen pada saluran pencernaan. Menyebabkan luka bakar pada saluran pencernaan.
Terhirup: Dapat menyebabkan iritasi pada saluran pernapasan dengan rasa sakit terbakar di hidung dan tenggorokan, batuk, mengi, sesak napas dan edema paru. Menyebabkan luka bakar kimia pada saluran pernapasan.
Kronis: Kontak kulit yang berkepanjangan atau berulang dapat menyebabkan dermatitis. Inhalasi yang berkepanjangan atau berulang dapat menyebabkan mimisan, hidung tersumbat, nyeri dada dan bronkitis. Kontak mata yang lama atau berulang dapat menyebabkan konjungtivitis. Efek mungkin tertunda. Pekerja yang terpapar kabut asam sulfat secara kronis dapat menunjukkan berbagai lesi pada kulit, trakeobronkitis, stomatitis, konjungtivitis, atau gastritis. Paparan di tempat kerja terhadap kabut asam anorganik kuat yang mengandung asam sulfat bersifat karsinogenik bagi manusia.
Penanganan
Mata: Jika terjadi kontak, segera basuh mata dengan banyak air selama minimal 15 menit. Dapatkan bantuan medis segera.
Kulit: Jika terjadi kontak, segera basuh kulit dengan banyak air selama minimal 15 menit sambil melepaskan pakaian dan sepatu yang terkontaminasi. Dapatkan bantuan medis segera. Cuci pakaian sebelum digunakan kembali.
Tertelan: Jika tertelan, jangan dimuntahkan. Dapatkan bantuan medis segera. Jika korban sadar penuh, berikan segelas air. Jangan pernah memberikan apapun melalui mulut kepada orang yang tidak sadarkan diri.
Terhirup: bahan racun. Jika terhirup, segera dapatkan bantuan medis. Pindahkan korban ke udara segar. Jika tidak bernafas berikan pernafasan buatan. Jika sulit bernafas, berikan oksigen.


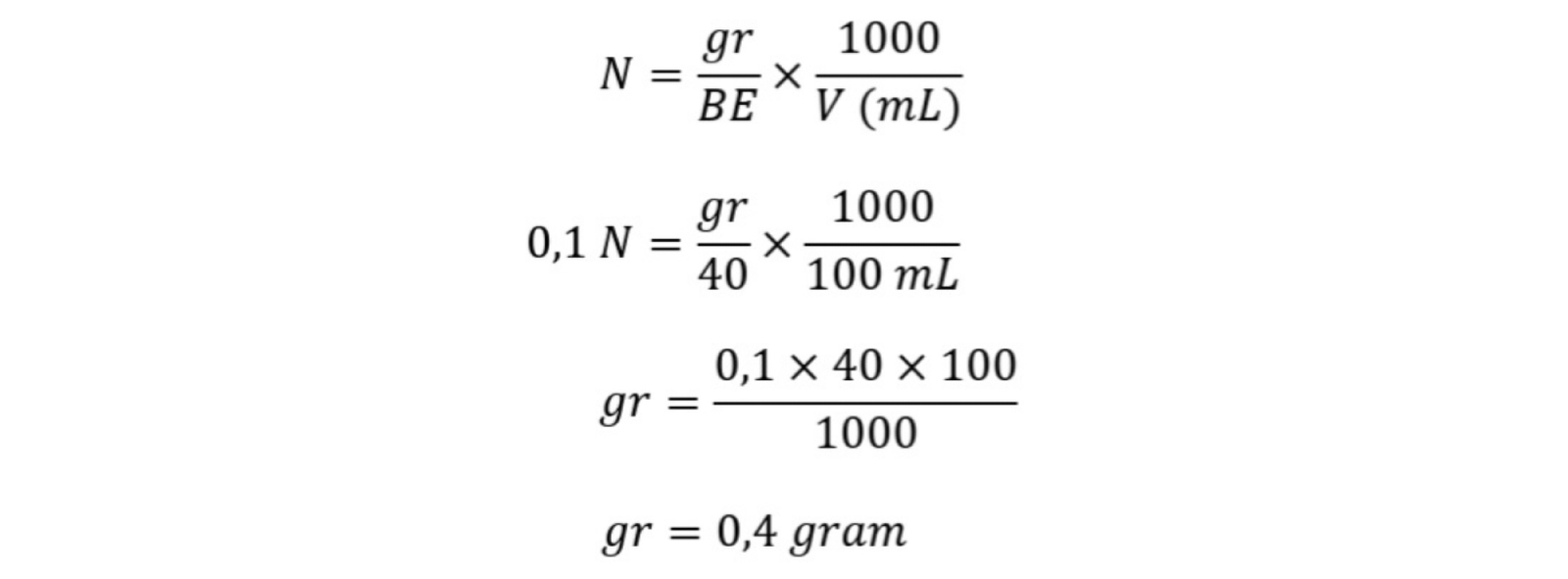





























Komentar
Posting Komentar